ARTÍCULO ORIGINAL
ANÁLISIS DE LA DINÁMICA BIOLÓGICA PRESENTE EN UN SISTEMA PILOTO DE LOMBRICULTURA PARA EL MANEJO DE BIOSÓLIDOS PROVENIENTES DE AGUAS RESIDUALES
ANALYSIS OF BIOLOGICAL DYNAMICS REMAINS IN VERMICULTURE PILOT SYSTEM FOR THE MANAGEMENT OF BIOSOLIDS RISING FROM WASTEWATER
Álvaro Chávez Porras*; Alejandra Rodríguez González**; Fabián Eduardo González Gómez***
** Ing. Industrial, Doctor en Ingeniería Civil, Área Ambiental. Profesor Asistente, Facultad de Ingeniería, Líder Grupo Producción, Innovación y Tecnología, Universidad Militar Nueva Granada, Bogotá D.C. Colombia. Correo electrónico: alvaro.chavez@unimilitar.edu.co.
*** Bióloga, Estudiante Maestría Gestión del Medio Natural – Universidad Internacional de Andalucía, España, Joven Investigador COLCIENCIAS y Asistente de investigación, Grupo Producción, Innovación y Tecnología, Universidad Militar Nueva Granada, Bogotá D. C., Colombia. Correo electrónico: grupopit@unimilitar.edu.co.
**** Biólogo, Esp. Planeación Ambiental, Auxiliar de investigación, Facultad de Ingeniería, Grupo Producción, Innovación y Tecnología, Universidad Militar Nueva Granada, Bogotá D. C., Colombia. Correo electrónico: grupopit@unimilitar.edu.co.
Recibido: 04/06/2012
Aceptado:: 07/05/2013
RESUMEN
Se analizó la dinámica biológica presente en un sistema piloto de lombricultura con la especie Eisenia foetida para el manejo de biosólidos provenientes de la Planta de Tratamiento Aguas Residuales –PTAR– Salitre, Bogotá D. C., con el fin de establecer la influencia de los organismos presentes en la transformación y translocación de la materia orgánica –MO–, la eficiencia de este proceso, así como la calidad del humus y su posible uso como abono orgánico. Esto, mediante análisis biológicos en diferentes etapas. En la primera fase del sistema se identificó que los biosólidos están clasificados como tipo B de acuerdo con la EPA (Agencia de Protección del Medioambiente de los EE. UU.), y presentan condiciones desfavorables para su aplicación a cultivos agrícolas. Sin embargo, luego de dos meses de procesamiento biológico, el humus tuvo características similares a las de un compost maduro, con baja presencia de microorganismos patógenos, así como también un leve aumento en la diversidad y equitatividad de la meso y la macrofauna.
PALABRAS CLAVE
Biosólidos, lombricompostaje, PTAR y humus.
ABSTRACT
The biological dynamics in a pilot vermiculture system with the Eisenia foetida specie for managing biosolids taken from the waste water treatment plant, WWTP - Salitre, Bogotá D.C., was analyzed to establish the influence of organisms present in the process of transformation and translocation of organic matter (OM); the study also considers the process efficiency, and the quality of humus and its possible used as mulch. The study was performed by biological analysis in different phases of the process. In the first phase of the process, the biosolids were identified as type B according to the EPA (United States Environmental Protection Agency) showing unfavorable condition for application to crops. However, after two months of biological processing, humus had similar characteristics to those of mature compost with low level of pathogenic microorganism, as a slight increase in diversity and evenness of meso and macrofauna.
KEY WORDS
Biosolids, vermicomposting, WWTP and humus.
INTRODUCCIÓN
Las plantas de tratamiento aguas residuales –PTAR–, afrontan un gran desafío en cuanto al manejo de los residuos obtenidos conocidos como biosólidos. En el mundo las investigaciones se han enfocado hacia la búsqueda de alternativas para su transformación, tratamiento y disposición final, con el fin de convertirlos en un material útil en las cadenas productivas [1]. De acuerdo con lo establecido en el Atlas Global de Residuos de Tratamiento de Aguas y Manejo de Biosólidos (2008), se puede observar que Estados Unidos es el país que genera mayor cantidad con 6'514.000 t, y una población aproximada de 298'444.000 habitantes, seguido de China con una producción de 2'966.000 t, y 1.313'974.000 habitantes [2].
En Colombia, la producción de lodos alcanza los 7400 m3 /día (73.9 t/día) [2], los cuales pasan por un proceso de digestión anaerobia que permite disminuir microorganismos patógenos y destruir parte de los componentes orgánicos biodegradables [3], luego de lo cual son definidos como biosólidos, pues consisten en un material orgánico como resultado del tratamiento de aguas residuales que puede ser reciclado [1]. Actualmente, en Bogotá D. C. se generan aproximadamente 92 t/mes y 1.102 t/año de biosólidos [3].
Una de las alternativas propuestas más rentables para la disposición final de estos es usarlos como acondicionadores o mejoradores de suelos, dado que encierran en su composición materia orgánica –MO–, así como también, macro y micronutrientes, haciendo que su contribución sea de suma importancia en lo que respecta al ahorro de recursos en la compra de fertilizantes; además, proporcionan una mejora en las características físico-químicas, en valores de nitrógeno, fosforo y potasio (N-P-K), y biológicas [1, 3].
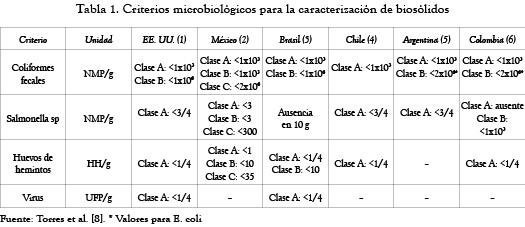
A pesar de que la norma EPA 40 CFR part 530 hace algunas restricciones en la aplicación directa a suelos agrícolas para los biosólidos tipo B (en la tabla 1 se muestran las características microbiológicas), permite su aplicación únicamente en cultivos donde los productos tengan un procesamiento posterior a la cosecha, como los cereales, lo cual no es recomendable, ya que pueden generar efectos adversos en las características naturales del suelo, debido a su composición físico-química y biológica. Por esta razón, se plantea el uso de procesos complementarios que permitan la estabilización y puedan ser usado como abono; uno de ellos es el compostaje, que posibilita mejorar las altas concentraciones de iones (CE), estabilizar el pH, disminuir las sustancias tóxicas como metales pesados (As, Cd, Cr, Cu, Ni, Pb, Se y Zn), así como reducir los microorganismos patógenos presentes. [4].
Para este caso se planteó el uso de un sistema de lombricultura o vermicultivo para el manejo, con el fin de que puedan ser usados como abono. En el proceso se involucró el uso de la lombriz de la especie Eisenia foetida o lombriz roja californiana, debido a su alta tasa de reproducción (un capullo por semana), alta producción de humus mediante la transformación y translocación de la MO, y alta resistencia a condiciones extremas [5].
En general, la lombricultura, a diferencia del compostaje, mejora las características físicas del sustrato, por el desplazamiento del individuo, como son la retención y la penetración del agua [6].
Por lo anterior, se analizó la dinámica biológica (micro y macro) presente en un sistema piloto de lombricultura para el tratamiento de biosólidos presentes en aguas residuales domésticas provenientes de la Planta de Tratamiento Aguas Residuales –PTAR– Salitre, Bogotá D. C.
1 MATERIALES Y MÉTODOS
1.1 Recolección del biosólido
La materia prima fue una muestra de biosólidos de la PTAR El Salitre de Bogotá D. C. correspondiente a 150 kg. La recolección se hizo en lonas plásticas que fueron transportadas hasta la sede de la Universidad.
Estos se obtuvieron mediante el proceso de sedimentación primaria de la planta; posteriormente, fueron espesados y digeridos anaerobiamente por 22 días a 35 °C, finalmente fueron llevados a una etapa de deshidratación con una sequedad media de 32 %.
1.2 Diseño del sistema piloto de lombricultura
Con el fin de identificar y analizar los diferentes procesos biológicos que ocurren durante la transformación y translocación, se estableció un esquema metodológico con diferentes actividades, que suministraron la información para la consecución de los objetivos. Además, se diseñó un sistema piloto, de tal forma que involucró la menor intervención antrópica en su operación.
El sistema consistió en un contenedor plástico con dimensiones de 0,90 m de ancho, 1,10 m de largo y 1,00 m de alto, con una capacidad de 0,99m3 que tenía una válvula en la parte inferior para el drenado de lixiviados.
En la figura 1, se muestra el contenedor utilizado como sistema piloto. En su interior se adecuó una capa de grava de 0,15 m de altura, seguido de una de biosólido (90 kg) de 0,15 m, y se finalizó con una superior de sustrato orgánico (tierra negra) < 0,01 m de altura, para un total aproximado de 0,30 m de altura. El sustrato orgánico (capa superior) estuvo compuesto por arcilla, limo, arena y material vegetal descompuesto. La figura 2 muestra el diseño y los componentes del sistema piloto de lombricultura.
Este sistema se protegió con una cubierta plástica, polisombra, con el fin de mitigar los efectos que tienen las variaciones climáticas que afectan el desarrollo de la especie.
1.3 Recolección de muestras
Se tomó una serie de muestras de 2 kg de biosólido, cada una, para el análisis en laboratorio, utilizando frascos de plástico transparentes.
Las muestras analizadas fueron:
• De biosólidos, proporcionados por la PTAR El Salitre, antes de ser dispuesto en el sistema piloto.
• De sustrato orgánico (tierra negra), antes de ser dispuesto en el sistema.
• De humus, tomado directamente del sistema, teniendo en cuenta la recolección en diferentes zonas para lograr una muestra homogénea, como se presenta en la figura 3.
La tabla 2 hace referencia al tipo de muestra tomada y su fecha de recolección, ya sea biosólidos (MB-lodo), sustrato (MB0), humus (MB1) y humus (MB2). Las muestras de humus se realizaron con el fin de evaluar los cambios en la composición biológica dentro del proceso.
1.4 Análisis de las muestras
Las muestras se enviaron para análisis al Laboratorio Nacional de Suelos del Instituto Geográfico Agustín Codazzi (IGAC), Bogotá D. C.
1.5 Análisis biológicos
– Aislamiento de microorganismos celulíticos aerobios (método: recuento en placa);
– Conteo general de hongos y bacterias (método: recuento en placa);
– Microorganismos fijadores de nitrógeno (método: recuento en placa);
– Microorganismos amonificantes-producción de amonio (método: número más probable –NMP–);
– Microorganismos nitrificantes-oxidación de nitrato (método: NMP);
– Solubilizadores de fosfato (método: recuento en placa);
– Evaluación de la producción de CO2 biológico en el suelo;
– Conteo de protozoos edáficos (método: técnica de conteo com cámara de Neubauer);
– Evaluación de mesofauna (método: embudo de Tullgren);
– Observación de macrofauna sobre el sistema piloto.
Los resultados se interpretaron por medio de los índices ecológicos:
– Índice de equitatividad (Simpson),
– Índice de riqueza (Margalef)
– Índice de diversidad (Shannon-Wiener).
2 RESULTADOS Y DISCUSIÓN
Los resultados del análisis de laboratorio de la muestra de biosólidos (MB-Lodo), antes de ser dispuesta en el sistema piloto para el proceso de lombricompostaje, se enuncian en la tabla 3, donde se evidenciaron condiciones desfavorables para su aplicación en cultivos, en razón de los altos niveles de respiración microbiana, coliformes fecales y bacterias de nitrificantes; ello indica que su estabilización no es completa y, por tanto, no debe usarse como abono [1, 7].
Los resultados obtenidos estos pertenecen a la clase B, y pueden ser usados en cultivos donde la parte de interés tengan un posterior procesamiento, como es el caso de los cereales; también son recomendados como cobertura de rellenos sanitarios, aplicaciones forestales y recuperación de suelos degradados [1]. Lo anterior se puede efectuar, ya que presenta una densidad de coliformes fecales inferior a 2 × 106NMP/g de sólidos totales o 2×106UFC/g de sólidos totales.
En general, los biosólidos tipo B deben recibir tratamiento posterior y son los de mayor restricción para uso agrícola [1]. La alta presencia de microorganismos pudo presentarse por el insuficiente tiempo de depuración del agua para alcanzar la degradación adecuada por parte de las poblaciones microbianas [4].
Los resultados microbiológicos de las muestras tomadas durante el proceso se indican en la tabla 4. En la muestra MB1, se encontró una elevada presencia de microorganismos patógenos en las primeras fases de transformación y translocación de la MO. Los factores que pudieron influir son:
• El pH de la muestra con valor de 5.5, que se encuentra fuera del rango óptimo (7.0-8.0) de degradación [6], lo que impide que los procesos metabólicos funcionen adecuadamente y no logren degradar en su totalidad los componentes presentes en el medio.
• La humedad registrada en las diferentes etapas fue >70 %, y la adecuada está entre 40-60 %. Teniendo en cuenta que su exceso pudo impedir que el oxígeno se difunda con eficacia hasta la superficie de las partículas, donde tiene lugar la mayor parte de la actividad biológica [4].
El resultado de la muestra final, MB2, indica que el humus está en la etapa de maduración, ya que los microorganismos predominantes fueron los actinomicetos. Los factores de humedad (>70 %) y pH (5.2) no son óptimos para seguir con la degradación [4, 6], e impidieron llegar a la maduración completa y a la estabilidad adecuada para ser usados directamente como abono [4]. Los valores determinados en los análisis indicaron que aún se podría realizar degradación, debido a la presencia de mesófilos (bacterias, actinomicetos y patógenos) que crecen a temperaturas óptimas entre 10-45 °C [8, 9].
Al comparar los resultados biológicos, se puede decir que el humus se va estabilizando con el tiempo, lo cual indica que las lombrices se adaptan a distintos tipos de desechos, y reducen malos olores y poblaciones de microorganismos nocivos, así como también minimizan los efectos de la contaminación por desechos orgánicos [10].
Los resultados de la caracterización de protozoos y nematodos edáficos, se presentan en la tabla 5. Estos indicaron una disminución en las poblaciones de nematodos patógenos y benéficos durante el proceso de lombricompostaje, como se muestra en la figura 4. Las altas temperaturas producidas en el proceso de degradación y la presencia de hongos nematófagos podrían ser las principales razones para el control de estas poblaciones [11]. Para la última muestra –MB2–, el humus obtenido presentó un alto número de nematodos patógenos. Por lo tanto, se recomienda hacer un pre-compostaje previo al lombricompostaje, con el fin de disminuirlas [5].
Por el contrario, las poblaciones de protozoos registraron un aumento durante el proceso, como se observa en la figura 5. Estos tienen un efecto en la presencia de los protozoos, ya que compiten por su fuente de alimentación: las bacterias. Por consiguiente, los suelos pueden tener un número elevado de nematodos o de protozoos, pero no de ambos [11]. Para la muestra MB2, los niveles poblacionales fueron los esperados para un humus [5].
Los resultados de la caracterización de la micro y macro fauna se presentan en la tabla 6, la cual se compone de la clasificación taxonómica hasta orden (familia en algunos grupos), el número de individuos por grupo y los índices ecológicos de las comunidades presentes en el sistema piloto, representados mediante los siguientes índices: Diversidad de Shannon-Weaver (H'), el cual se mide en unidades de bits/individuo cuando la escala logarítmica es base 2; Dominancia de Simpsom (D), el cual muestra la abundancia de las especies más comunes, por lo tanto, se refiere al mayor número de especies representadas en la muestra total de individuos (su valor va de 0 a 1); y la Riqueza de Margalef (R), que se refiere al mayor número de individuos representados en cada una de las muestras.
La figura 5 muestra la dominancia de la familia Isotomidae (Orden Collembola) de 1617 individuos (79,50 %), seguido de los ácaros Mesostigmata con 315 individuos (15,50 %) y ácaros Oribátidos con 98 individuos (4,82 %). Los órdenes Coleóptera y Díptera aparecieron en una baja proporción (0,08 %). No existe equitatividad en la distribución de individuos en los diferentes grupos, ya que existe predominancia del orden Collembola. Asimismo, la riqueza y diversidad general son muy bajas, situación propia de ambientes sometidos a uno o más factores de estrés ambiental o de ambientes muy especializados, como son las condiciones que se presentan en las etapas iniciales del proceso.
En la muestra MB1 se encontró una dominancia de ácaros; para el orden Oribátida se registraron 594 individuos y para el Mesostigmata 198 individuos, lo que representa una cantidad porcentual de 95,70 % del total. De igual manera, se encontraron estados larvarios y adultos del orden Coleóptero, en proporciones no significativas (4,20 %), como se observa en la figura 6. En la muestra MB0, los índices de diversidad y riqueza fueron bajos, lo que indica un ambiente con condiciones limitantes para el desarrollo de la edafofauna típica de sustratos no intervenidos por actividades antrópicas.
En la muestra MB2 se observó una abundancia relativamente baja, dominada por los Colémbolos Isotomidae con 24 individuos, seguido de la familia Onychiuridae con 3 individuos, lo que representa el 85,2 % del total de la muestra, como se evidencia en la figura 7. La distribución de individuos en los diferentes grupos indica una equitatividad media y una mayor diversidad de Colémbolos. La diversidad de especies encontradas se aproxima a la composición de la edafofauna presente en el humus [10].
Los macroporos que resultan de la actividad metabólica de E. foetida son estructuras consideradas como hábitat para algunos artrópodos que los usan como refugios específicos [12], ya que los macroagregados producido por las lombrices tienen un alto contenido de MO y representan un sustrato alimenticio valioso [13,14].
Existen relaciones interespecíficas negativas que se pudieron presentar en el sistema como lo son:
Depredación. Teniendo en cuenta la dieta de las lombrices [15], los restos de microartrópodos en el contenido intestinal y en las heces de estas se han determinado como ingestión accidental de la mesofauna [10].
Competencia. Se presenta en baja proporción en las primeras fases, ya que la presencia de mesofauna y macrofauna es baja. Sin embargo, en las etapas finales, algunos grupos como colémbolos y ácaros, se pueden ver afectados por la acción de lombriz, mientras que organismos como protozoos y nematodos son favorecidos [16].
3. CONCLUSIONES Y RECOMENDACIONES
Primeramente, el análisis muestra que los biosólidos de la PTAR Salitre presentan condiciones desfavorables para su aplicación en cultivos, en razón a los altos niveles de respiración microbiana y coliformes. Esto indica que deben recibir tratamiento antes de su uso agrícola.
La elevada presencia de microorganismos que se evidencia en las primeras fases de transformación y translocación de la MO dentro del sistema se debió a factores como la acidez del medio, exceso de humedad, proporción de microorganismos y alimento disponible; a su vez, la dominancia de Colémbolos Isotomidae y Ácaros Mesostigmata en estas fases indica un ambiente sometido a factores de estrés ambiental y alto grado de contaminación. En la fase MB2 se obtuvo que índices de diversidad y riqueza de la edafofauna fueron bajos, comparados con otros ecosistemas edáficos naturales. No obstante, el aumento en el valor de los índices y la equitatividad media entre las poblaciones con respecto al estado inicial supone que se presentan condiciones favorables para la colonización de nuevas especies; de igual forma, la presencia de mesófilos (bacterias, actinomicetos y patógenos) indica que el proceso se debe llevar a cabo por mayor tiempo para que se complete el proceso y pueda ser aplicado como abono.
Finalmente, el aumento de las poblaciones de microinvertebrados sobre las capas más superficiales (sustrato-humus) indica que la especie Eisenia foetida no presentó relaciones interespecíficas negativas (depredación o competencia), sino, por el contrario, el humus producido por esta genera mejores condiciones ambientales del suelo para la colonización de nuevas especies importantes en la mineralización de la MO.
En conclusión, para el control de microorganismos patógenos, se recomienda hacer un pre-compostaje para la estabilización del biosólido antes del lombricompostaje. Después, se recomienda realizar pruebas de sobrevivencia, como la P 50L, (prueba de las cincuenta lombrices), durante 48 horas, con el fin de verificar que los biosólidos y el humus no afecten el metabolismo de las lombrices. De igual forma, se puede aplicar cal para estabilizar el pH del medio y favorecer su desarrollo, al igual que el crecimiento de poblaciones microbianas controladoras de patógenos.
Para mejorar la eficiencia del proceso y establecer la mejor formulación del humus, se recomienda evaluar, en primer lugar, el crecimiento y la población de lombrices, mediante el método de cuarteamiento, analizando muestras homogéneas sobre cada tratamiento. Igualmente, es necesario realizar ensayos suficientes (control, tratamientos y réplicas) que puedan ser analizados mediante métodos estadísticos, donde se compare con diferentes sustratos para la mezcla con biosólidos.
REFERENCIAS
[1] United States Environmental Protection Agency - EPA. ''A guide to the biosolids risk assessments for the EPA Part 503 rule'', Washington: Office of Wastewater Management / EPA. 1994.
[2] R. LeBlanc, et al., ''Global atlas of excreta, wastewater sludge and biosolids management: moving forward the sustainable and welcome uses of resource''. United Nations Human Settlements Programme: UN-HABITAT, 2008, 632 p.
[3] Acueducto, Agua y Alcantarillado de Bogotá. ''Planta de Tratamiento de Aguas Residuales El Salitre-Fase I. Informe de actividades diciembre 2011-enero 2012. Bogotá, 2011, 101 p.
[4] H. Campbell. ''Sludge Management: Future Issues and Trends''. Water Science and Technology, vol. 41 n.° 8. 2000.
[5] L. Durán y C. Henríquez. ''Crecimiento y reproducción de la lombriz roja (Eisenia foetida) en cinco sustratos orgánicos''. Agronomía Costarricense, vol. 33, n.° 2, pp. 275-281. 2009.
[6] C. Martínez. ''Abonos orgánicos: Lombricultura''. En: Sistema de Agronegocios de Traspatio, C. Martínez (ed.), México, Secretaría de Agricultura, Ganadería, Desarrollo rural, Pesca y Alimentación (SAGARPA), En: http://www.sagarpa.gob.mx/desarrolloRural/Documents/fichasaapt/Lombricultura.pdf. pp. 1-8, 2009.
[7] C. Villanueva. ''Valoración del humus, elaborado con lodos biológicos de plantas de tratamiento de aguas servidas de ESSBIO S. A., mediante lombricompostaje''. P. 107. 2007.
[8] P. Torres, et al., ''Mejoramiento de la calidad microbiológica de biosólidos generados en plantas de tratamiento de aguas residuales domésticas''. Revista EIA. Vol. 11, pp. 21-37. 2009.
[9] E. Martínez, et al., ''Carbono orgánico y propiedades del suelo''. R. C. Suelo Nutr. Veg. Vol. 8, n.° 1, pp. 68-96. 2008.
[10] M. Gutiérrez. ''Efecto de la lombriz Hormogaste relisae Álvarez, 1977 sobre los microartrópodos edáficos de El Molar (Madrid)''. (En línea) Memoria para optar al título de Doctorado en Biología. Facultad de Biología. Universidad Complutense de Madrid. pp. 259. 2006.
[11] M. Zimmeret al., ''Nutrition interrestrial isopods (Isopoda: Oniscidea): an evolutionary-ecological approach''. BiologyReview. N.° 77, pp. 455-493, 2002.
[12] E. Mirabelli. ''El Compostaje proyectado a la Lombricultura''. Editorial Hemisferio Sur. pp. 336.2008.
[13] BR Global, LLC. ''Importancia de los micronutrientes''. En: http://www.brglimited.com/download/MicroNutrientes.pdf. 2001.
[14] T. Decaens, et al., ''Las Comunidades de la Macrofauna de la Superficie del Suelo Asociadas con las Heces de las Lombrices de Tierra en los Llanos Orientales de Colombia''. En: Las Comunidades de Macroinvertebrados del Suelo en las Sabanas Neotropicales de Colombia.Cali, Colombia: Publicaciones CIAT N.° 336. 2003.
[15] R. Anderson, et al., ''Trophic interactions in soils as they affect energy and nutrient dynamics. III. Bioticinteractions of bacteria, amoebae and nematodes''. Microbiology Ecology, vol. 4, n.° 4, p 361-371. 1977.
[16] M. Maraun, et al., ''Indirect effects of carbon and nutrient a mendments on the soil meso-and microfauna of a beechwood''. Biology and Fertility of Soils, n.° 34. pp. 222-229.2001.